สารบัญ

แก๊สอุดมคติ คืออะไร
เมื่อพูดถึงแก๊ส หรือ ก๊าซ นี่คือหนึ่งในสถานะของสสารที่ทุกคนคุ้นเคยกันดี ซึ่งในเชิงวิทยาศาสตร์จะมีการแบ่งประเภทของแก๊สออกเป็น “แก๊สอุดมคติ” และ “แก๊สจริง” จึงอยากพาทุกคนไปศึกษาเพื่อสร้างความเข้าใจอย่างถูกต้องรวมถึงทฤษฎีแก๊สอุดมคติที่เกี่ยวข้องด้วย ยืนยันว่าไม่ใช่เรื่องยากและสามารถต่อยอดเพื่อการเรียนรู้ในอนาคตได้แน่นอน
แก๊สอุดมคติ คืออะไร
แก๊สอุดมคติ (Ideal Gas) คือ นิยามของแก๊สที่นักวิทยาศาสตร์ได้มีการกำหนดขึ้นเพื่ออธิบายถึงสมบัติและพฤติกรรมที่เกี่ยวข้องกับแก๊ส ช่วยให้การศึกษาในเรื่องดังกล่าวง่ายขึ้น ซึ่งปกติแล้วจะเป็นไปตามทฤษฎีจลน์ของแก๊ส (Kinetic Theory of Gases) ต่อให้อยู่ในสภาวะหรืออุณหภูมิแบบใดก็ตาม แม้ในความเป็นจริงแก๊สตามธรรมชาติจะไม่ได้ตรงกับกฎแต่ละข้อแบบแม่นยำก็ตามยิ่งเมื่ออยู่ในสภาวะอุณหภูมิต่ำหรือมีระดับความดันสูง บ่อยครั้งอาจถูกเรียกว่า “แก๊สสมบูรณ์” ซึ่งเป็นแก๊สที่จะไม่มีการยึดเหนี่ยวระหว่างโมเลกุล
ทฤษฎีของแก๊สอุดมคติ
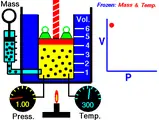
1. กฎของบอยล์ (Boyle’s Law)
เป็นทฤษฎีของ โรเบิร์ต บอยล์ (Robert Boyle) นักเคมีฟิสิกส์ชาวอังกฤษ ระบุว่า “ปริมาตรของแก๊สใดก็ตามเมื่อมีมวลคงที่ จะเกิดการแปรผกผันกับความดันของแก๊สนั้น ๆ เมื่ออุณหภูมิมีค่าคงที่” ด้วยสูตรดังนี้
V ∝ 1/P
P ∝ 1/V หรือ PV = k
P = ความดัน, V = ปริมาตร, k = ค่าคงที่
โดยข้อสรุปคือเมื่ออุณหภูมิและมวลของแก๊สคงที่ ผลคูณของความดันกับปริมาตรของแก๊สใด ๆ ย่อมมีค่าคงที่เสมอ ตามกฎของบอยล์ เมื่อความดันของแก๊สเปลี่ยนจาก P1 เป็น P2 ปริมาตรของแก๊สย่อมเปลี่ยนจาก V1 เป็น V2 เสมอ นั่นหมายถึงผลคูณระหว่างความดันกับปริมาตรในภาวะทั้งสองมีค่าเท่ากันดังสมการ P1V1 = P2V2
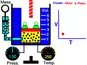
2. กฎของชาร์ลส์ (Charles’s Law)
เป็นทฤษฎีของ ฌาก อเล็กซอง เซซาร์-ชาร์ลส์ (Jacques Alexandre César-Charles) นักวิทยาศาสตร์ชาวฝรั่งเศส ระบุว่า “ปริมาตรของแก๊สใด ๆ หากมีมวลคงที่ย่อมเกิดการแปรผกผันกับอุณหภูมิ (เคลวิน) ของแก๊สนั้น ๆ เมื่อความดันมีค่าคงที่” ด้วยสูตรดังนี้
V ∝ T
V = kT หรือ V/T = k
V = ปริมาตร, T = อุณหภูมิ, k = ค่าคงที่
ด้วยอัตราส่วนของ V กับ T เป็นค่าคงที่ ดังนั้น V1 T2 = V2 T1 หรือ V1/T1 = V2/T2 เสมอ
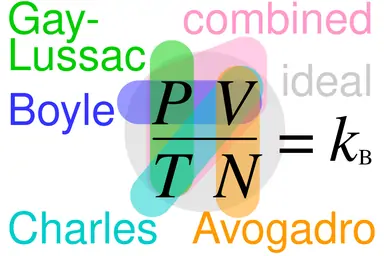
3. กฎของอาโวกาโดร (Avogadro’s Principle)
เป็นทฤษฎีของ อาเมเดโอ อาโวกาโดร (Amedeo Avogadro) นักวิทยาศาสตร์ชาวอิตาเลียน ระบุว่า “เมื่ออุณหภูมิและความดันเดียวกัน ก๊าซต่างชนิดที่มีปริมาตรเท่ากันต้องมีจำนวนโมเลกุลหรืออนุภาคเท่ากันเสมอ”
V ∝ n หรือ V/n = k
V = ปริมาตร, n = จำนวนโมลของแก๊ส, k = ค่าคงที่
นั่นหมายถึงแก๊สทุกชนิดจะมีปริมาตรเพิ่มขึ้นหากจำนวนโมเลกุลของแก๊สเพิ่มขึ้น ต่อมาเมื่อทฤษฎีดังกล่าวถูกยอมรับ ตัวเลข 1 โมลของแก๊ส (จำนวนอนุภาคเท่ากับ 6.02 x 1023) จึงถูกตั้งชื่อว่า “เลขอาโวกาโดร” (Avogadro Number)
ทั้งนี้จากกฎของ 3 ข้อด้านบน ได้ถูกผนวกเข้าเป็น “กฎรวมแก๊ส” (Combined Gas Law) ตามสมการดังนี้
P1V1/T1 = P2V2/T2
P = ความดัน, V = ปริมาตร, T = อุณหภูมิ
ซึ่งจากกฎรวมแก๊สยังเปลี่ยนเป็นกฎของแก๊สอุดมคติ ภายใต้กฎของอาโวกาโดร ตามสมการนี้
PV=nRT
P = ความดัน, V = ปริมาตร, n = จำนวนโมล, R = ค่าคงตัวของก๊าซอุดมคติ, T = อุณหภูมิ
นี่คือเรื่องของแก๊สอุดมคติเบื้องต้นที่หยิบมาแนะนำให้กับทุกคนได้ศึกษากัน ส่วนเด็ก ๆ คนไหนที่สนใจเรียนคอร์สเคมี สอวน. ครูปีโป้ยินดีเป็นผู้ช่วยให้การสอบเข้าค่าย สอวน. เป็นเรื่องง่ายขึ้น เรียนสนุก ความรู้ครบถ้วน เพิ่มเติมทักษะกันได้เลย

